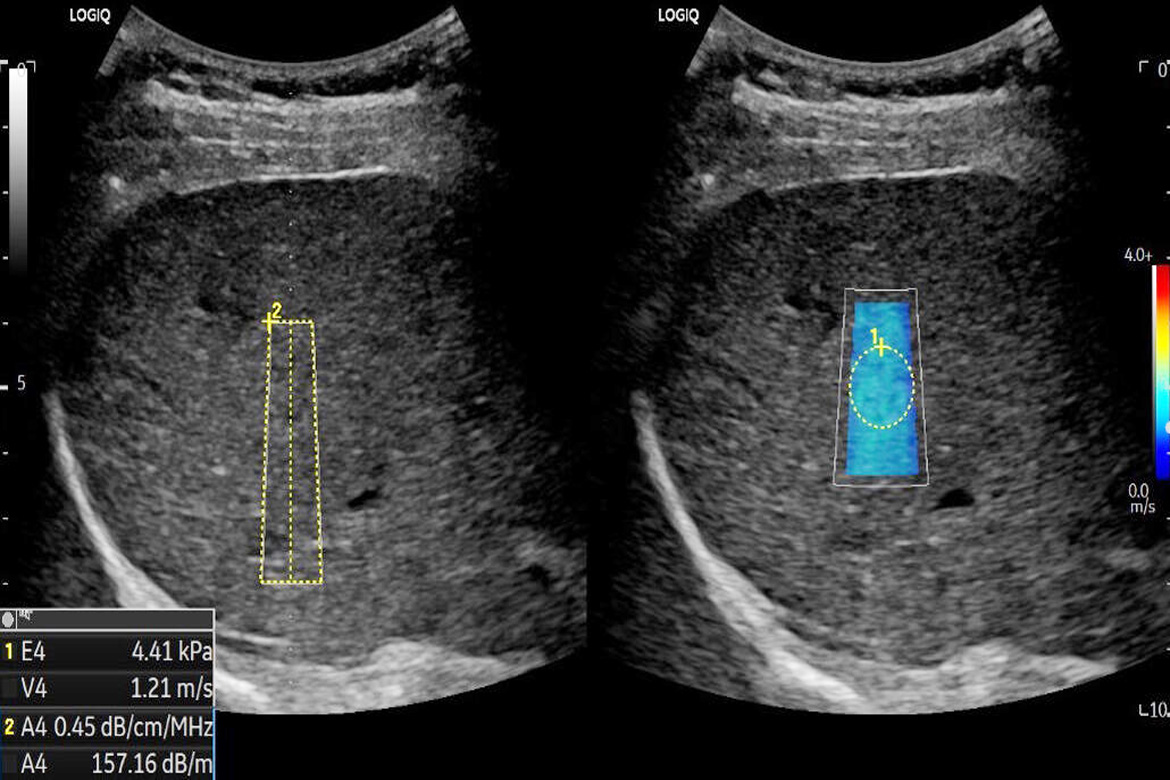
Tăng huyết áp là một trong các bệnh phổ biến nhất trên thế giới gây tử vong và tàn phế. Ước tính có 0,5% đến dưới 5% các bệnh nhân tăng huyết áp do bệnh động mạch thận thực sự [1,2], được định nghĩa là tăng huyết áp do hẹp động mạch thận. Ngoài gây tăng huyết áp, hẹp động mạch thận cũng có thể gây suy thận. Trên thực tế, Scoble và Hamilton [3] gợi ý rằng có tới 40% các trường hợp tăng huyết áp người già có rối loạn chức năng thận và không có bệnh thận nguyên phát thì có hẹp động mạch thận đáng kể. Điều trị nội khoa ít có cơ hội thành công ở các bệnh nhân tăng huyết áp động mạch thận, trong khi phẫu thuật hoặc tái tạo mạch thận qua da là các phương pháp điều trị hiệu quả.
Do đó sàng lọc các bệnh nhân tăng huyết áp có nguy cơ cao do hẹp động mạch thận rất quan trọng, bởi vì hẹp động mạch thận có thể chữa khỏi. Tuy nhiên, sàng lọc chỉ hiệu quả ở các bệnh nhân có nguy cơ cao (bảng 1), tỉ lệ lưu hành hẹp động mạch trong các bệnh nhân này xấp xỉ 20% tới 30% [4].
Bảng 1: Các yếu tố nguy cơ lâm sàng đối với tăng huyết áp động mạch thận
| – Cơn tăng huyết áp nặng đột ngột (huyết áp tâm trương > 120 mmHg)- Tăng huyết áp nhanh (accelerated) hoặc tăng huyết áp ác tính (bệnh võng mạch độ III hoặc IV)- Tăng huyết áp kháng thuốc với chế độ 3 thuốc thích hợp- Khởi phát tăng huyết áp trước 30 tuổi hoặc sau 60 tuổi– Tăng huyết áp có suy thận tiến triển nhanh
– Suy thận tỏ ra đáp ứng với nhóm ACE inhibitor – Tăng huyết áp kết hợp với tiếng thổi ở ổ bụng – Các cơn tăng huyết áp nặng và phù phổi tái diễn – Không có tiền sử gia đình về tăng huyết áp |
Hẹp động mạch thận do vữa xơ động mạch là nguyên nhân phổ biến hơn ở nam giới và bệnh nhân vữa xơ động mạch ngoại vi. Hẹp vữa xơ điển hình xảy ra ở đoạn gần 1cm của thân động mạch thận, lỗ, các chỗ chia nhánh. Nguyên nhân phổ biến thứ hai gây hẹp động mạch thận là loạn sản xơ cơ. Loạn sản xơ cơ động mạch thận có xu hướng xảy ra ở nữ trẻ tuổi cho đến trung niên, và hẹp thường ở đoạn giữa cho tới đầu xa động mạch chính thận. Hai nguyên nhân này gây hẹp động mạch thận hai bên có tới 50% các trường hợp. Các nguyên nhân hiếm khác gồm có viêm mạch máu (viêm động mạch Takayasu), bệnh u xơ thần kinh, viêm mạch phóng xạ, bóc tách động mạch chủ hoặc động mạch thận, nghẽn mạch, hẹp động mạch chủ bụng bẩm sinh, hoặc chèn ép từ bên ngoài do khối u hoặc khối máu tụ. Tuy nhiên, các nguyên nhân của hẹp động mạch thận là phân bố theo địa lý và có sự thay đổi đáng kể trên thế giới. Thí dụ, ở Ấn Độ, viêm động mạch Takayasu chiếm 2/3 các trường hợp tăng huyết áp động mạch thận.
Đối với các động mạch thận hẹp do vữa xơ giảm đường kính 75% hoặc hơn thì nguy cơ tắc từ 12% tới 20% trong vòng 1 năm. Nếu đường kính giảm 50% hoặc hơn thì 20% tới 50% tiến triển bệnh nặng hơn trong vòng vài năm. Hơn nữa, giảm chiều dài thận khoảng 1 cm hoặc hơn mỗi năm ở khoảng 19% bệnh nhân có hẹp động mạch thận 60% [5]. Textor và Wilcox [6] đã báo cáo rằng 5% tới 16% các tổn thương vữa xơ không điều trị phát triển tới tắc hoàn toàn.
Siêu âm Doppler là một trong các phương tiện chẩn đoán không xâm lấn được lựa chọn trong chẩn đoán, sàng lọc, theo dõi tăng huyết áp động mạch thận. Siêu âm Doppler được dùng để sàng lọc hẹp động mạch thận từ những năm 1980, các tiêu chuẩn chẩn đoán thay đổi theo từng tác giả, kết quả nhiều khi trái ngược nhau. Trong bài này, chúng tôi trình bày các chỉ số đánh giá hẹp có độ tin cậy cao nhất trong y văn nên báo cáo trong kết quả chẩn đoán.
Kỹ thuật và các dấu hiệu bình thường
Bệnh nhân nên nhịn ăn trước khi siêu âm 8 đến 12 giờ. Sử dụng đầu dò siêu âm 2,5-3 MHz. Động mạch thận trái xuất phát từ thành trái động mạch chủ, ngay bên dưới tĩnh mạch thận và thường nhìn rõ trên các mặt cắt ngang trước bụng. Nếu gốc hai động mạch thận bị khí che, người ta có thể cắt đứng ngang động mạch chủ bụng ở bệnh nhân gầy, gọi là hình “vỏ chuối”-“banana peel”. Tiếp theo động mạch thận chính là các động mạch thùy nằm trong rốn thận tăng âm, và phân nhánh thành động mạch gian tiểu thùy chạy ra ngoài tới tháp thận. Động mạch cung chạy sau tháp thận và song song với vỏ thận. Chỉnh tối ưu Doppler màu và Doppler xung là cần thiết để đánh giá chính xác mạch thận (xem Bảng). Các lớp cắt siêu âm và tư thế để bộc lộ động mạch thận chính và trong nhu mô được trình bày trong sơ đồ sau và các hình minh họa kèm theo.
| Chỉnh siêu âm Doppler màu | Đánh giá kiểu dòng chảy | Đánh giá mạch máu nhỏ |
| Chẩn đoán hẹp | Đo dòng chảy chậm | |
| PRF | Càng cao càng tốt | Thấp |
| Color box | Nhỏ | Khá lớn |
| Doppler angle | Trung gian (300 – 600) | Càng nhỏ càng tốt |
| Wall filter | Trung gian | Thấp |
| Color gain | Trung gian | Cao |
| Chỉnh siêu âm Doppler xung | Đánh giá dòng chảy nhanh | Đánh giá dòng chảy chậm |
| PRF | Càng cao càng tốt | Càng thấp càng tốt |
| Wall filter | Trung gian | Thấp |
| Doppler angle | 700 – 900 | Càng nhỏ càng tốt |
| Transducer | Tần số thấp | Tần số cao hơn |

Sơ đồ 1: Kỹ thuật siêu âm Doppler màu khảo sát các động mạch thận. 1 = động mạch chủ, 2 = động mạch thận phải, 3 = động mạch thận trái, 4 = tĩnh mạch chủ dưới, 5 = tĩnh mạch thận phải, 6 = tĩnh mạch thận trái, 7 = động mạch thùy, 8 = động mạch gian thùy, 9 = động mạch cung, 10 = động mạch mạc treo trang trên, 11 = gan. (a) Sơ đồ trình bày kỹ thuật khảo sát các động mạch thận phải. A = siêu âm đường bên (qua thận) đoạn xa của động mạch thận phải và các nhánh động mạch thận phải (Hình 1); B = đường cắt siêu âm ngang trước bụng đoạn gần động mạch thận phải (Hình 1); C = đường cắt bên ngang trước bụng đoạn giữa động mạch thận phải (Hình 1); D = đường cắt siêu âm bên (qua gan) cuống động mạch thận phải (thực hiện khi không khảo sát đường từ đường trước bụng)(Hình 2) và đường cắt dọc khảo sát tĩnh mạch chủ dưới và đoạn giữa của động mạch thận phải đi sau tĩnh mạch chủ dưới (Hình 3). (b) Sơ đồ trình bày kỹ thuật khảo sát các động mạch thận trái. A = siêu âm đường bên (qua thận) đoạn xa của động mạch thận trái và các nhánh động mạch thận trái (Hình 1); B= đường cắt siêu âm ngang trước bụng đoạn gần và đoạn giữa động mạch thận trái (Hình 1); C =đường cắt bên (qua gan) đoạn gần của động mạch thận trái (khi không khảo sát được từ đường trước bụng). (từ Hélénon, Radiographics, 1995)

Hình 1. Các ảnh siêu âm của động mạch thận chính. (A) ảnh siêu âm động mạch thận phải và trái (các mũi tên dài) từ động mạch chủ. Lưu ý tĩnh mạch thận trái (mũi tên cong) phía trước động mạch chủ, IVC = tĩnh mạch chủ dưới, S = cột sống. (B, C) ảnh của động mạch thận phải chính (mũi tên dài), tĩnh mạch chủ dưới (mũi tên ngắn). Lưu ý IVC và các tĩnh mạch thận (mũi tên ngắn) nằm trước động mạch thận và động mạch chủ. (D, E) ảnh đoạn gần của động mạch thận trái chính (mũi tên) và động mạch chủ.

Hình 2. ảnh siêu âm màu lớp cắt qua gan, chếch đầu dò từ rốn thận tới động mạch chủ thấy toàn bộ chiều dài động mạch thận phải (mũi tên). L = gan, K = thận phải, A = động mạch chủ.

Hình 3. Ảnh siêu âm thang xám cắt dọc tĩnh mạch chủ dưới (IVC) cho thấy đoạn giữa động mạch thận phải (mũi tên) chạy ngang phía sau.
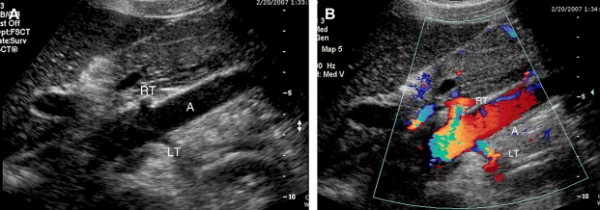
Hình 4. Các ảnh siêu âm thang xám (A) và Doppler màu (B) hình “vỏ chuối” cắt đứng ngang qua động mạch chủ bụng cho thấy góc động mạch thận phải (RT) và trái (LT).

Hình 5. Nhiều động mạch thận. Ảnh A cho thấy động mạch thận phụ bên phải (mũi tên) đi sau tĩnh mạch chủ dưới. Ảnh B cắt đứng ngang chếch qua động mạch chủ bụng thấy hai động mạch thận phải, động mạch cực trên nhỏ hơn, tĩnh mạch chủ dưới (màu xanh). Ảnh C cắt đứng dọc qua thận phải thấy 2 động mạch thận ở rốn thận.

Hình 6. Ảnh siêu âm màu cắt đứng dọc thận cho thấy các động mạch thùy (mũi tên dài), các động mạch gian tiểu thùy.

Hình 7 (A, B) Nhìn thấy toàn bộ động mạch thận phải bằng lớp cắt trước bên (qua gan) trên siêu âm thang xám. Đôi khi các nhiễu ảnh lóe màu do chuyển động của bệnh nhân có thể làm mờ động mạch thận phải. Độ phân giải không gian của siêu âm thang xám tốt hơn Doppler màu, và tốc độ ảnh cũng nhanh hơn nên giúp nhìn rõ động mạch hơn.
Cách đo và phân tích các số đo động mạch thận
PSV của động mạch chủ bụng đo ở ngang mức gốc động mạch thận. PSV động mạch thận đo ở lỗ, đoạn giữa và rốn thận, và bất cứ chỗ nào có aliasing màu.
Đối với mạch máu nhu mô, tối ưu nên đo 3 sóng Doppler ở mỗi cực trên và dưới thận. Phân tích các chỉ số sau ở sóng của động mạch thùy hoặc liên thùy: chỉ số tăng tốc (AI, acceleration index), thời gian tăng tốc (AT, acceleration time), chỉ số kháng (RI, resistive index). AI được tính từ điểm khởi phát tâm thu tới phức hợp đỉnh tâm thu sớm (đường dốc thẳng), AT là khoảng thời gian từ điểm khởi phát tâm thu tới phức hợp đỉnh tâm thu sớm. PSV không phải luôn trùng với đỉnh phức hợp tâm thu, bởi vì bình thường luôn có một khía hình chữ V tâm thu sớm. Đo không đúng dẫn đến tính sai AI và AT do có nhiều dạng sóng khác nhau (xem sơ đồ và cách đo).

Sơ đồ 2: Các kiểu sóng Doppler. Kiểu A và B biểu hiện phổ Doppler bình thường. Trong kiểu A, đỉnh ở cuối giai đoạn tăng sớm. Trong kiểu B, không có đỉnh nhưng đường tăng tốc vẫn thẳng. Lưu ý sóng VI được coi là bình thường mặc dù đỉnh cao; đây là kiểu hay gặp ở người trẻ. Kiểu C biểu hiện phổ bất thường với nhiều mức độ tăng tốc sớm bị chậm khác nhau. (từ Gilles Soulez, Radiographics, 2000).

Sơ đồ 3. AI là dốc thẳng nối điểm khởi đầu tâm thu và phức hợp đỉnh tâm thu sớm. AT là khoảng thời gian giữa hai điểm. (A) Hình sóng động mạch thận bình thường. (B) Hình sóng bất thường với chậm tăng tốc tâm thu chỉ ra hẹp đoạn gần thân động mạch. (C) Hình sóng nhỏ-chậm chỉ ra hẹp nhiều ở đoạn gần. (từ Hicham Moukaddam, Ultrasound Clin 2, 2007, 455–475).
Khảo sát Doppler xung động mạch bình thường có sóng trở kháng thấp với dòng chảy tâm thu tiến lên liên tục và đỉnh tâm thu nhọn (Hình 8A, B). PSV điển hình dưới 100 cm/s ở động mạch thận chính và giảm dần ở đầu xa. RI < 0,7 ở động mạch trong nhu mô (0,58-0,64)[7], và AT bình thường dưới 70ms (Hình 8C).

Hình 8. Sóng Doppler xung bình thường của động mạch thận. (A) Phổ Doppler động mạch thùy thận trong nhu mô cho thấy đỉnh tâm thu nhọn và dòng chảy tâm thu tiến lên liên tục. Trong trường hợp này điểm PSV trùng với phức hợp đỉnh tâm thu sớm. (B) Phổ Doppler động mạch thận bình thường ở một bênh nhân khác cho thấy khía hình chữ V tâm thu sớm hay phức hợp tâm thu sớm (mũi tên) trước PSV (+).(C) Đo thời gian tăng tốc bình thường (20 ms).
Độ chính xác của các thông số Doppler trong chẩn đoán hẹp động mạch thận
Siêu âm thang xám chủ yếu tìm mảng xơ vữa, không có giá trị xác định hẹp động mạch thận.
Các thông số Doppler trong chẩn đoán hẹp động mạch thận được sử dụng với ngưỡng khác nhau ở nhiều tác giả, dẫn tới các kết quả khác nhau, với độ nhậy biến đổi rất rộng giữa 0%-93% [8-11].
Năm 2007, G. J. Williams và đồng sự [12] đã tiến hành phân tích tổng hợp toàn bộ y văn (meta-analysis) về các nghiên cứu siêu âm Doppler xung trong chẩn đoán hẹp động mạch thận, để nhận ra các thông số và các ngưỡng tốt nhất (xem bảng). Nghiên cứu đã kết luận: siêu âm sàng lọc hẹp động mạch có độ chính xác vừa phải. PSV là thông số có hiệu năng cao nhất. Các thông số thêm vào không làm tăng độ chính xác.
Bảng: độ nhậy, 1 – độ đặc hiệu, và tỉ số khả dĩ [12]
| Tốc độ đỉnh(n = 21) | Thời gian tăng tốc(n = 13) | Chỉ số tăng tốc (n = 13) | Tỉ số động mạch chủ/ động mạch thận(n = 13) | |
| Độ nhạy | 0.85 (0.76–0.90) | 0.80 (0.62–0.91) | 0.74 (0.55–0.87) | 0.78 (0.67–0.86) |
| 1 – Độ đặc hiệu | 0.08 (0.05–0.13) | 0.12 (0.05–0.25) | 0.15 (0.07–0.29) | 0.11 (0.06–0.17) |
| Tỉ số khả dĩ dương | 10.2 (6.3–16.5) | 6.6 (2.8–15.2) | 4.8 (2.4–9.9) | 7.3 (4.3–12.3) |
| Tỉ số khả dĩ âm | 0.2 (0.1–0.3) | 0.2 (0.1–0.5) | 0.3 (0.2–0.6) | 0.2 (0.2–0.4) |
Ghi chú: n (số nghiên cứu đủ tiêu chuẩn). Số trong ngoặc là độ tin cậy 95%.
Các ngưỡng sau được nhiều trung tâm áp dụng để chẩn đoán hẹp động mạch có ý nghĩa về huyết động (giảm đường kính 50% tới 60% là ngưỡng thay đổi độ chênh áp lực có thể đo trong thực nghiệm)[13,14]:
– PSV động mạch thận chính 200 cm/s (có độ nhạy 85%, độ đặc hiệu 92%). Một số tác giả chọn ngưỡng PSV 180 cm/s.
– RAR (Tỉ số V động mạch thận/Vđộng mạch chủ) > 3.
– AT > 70 ms.

Hình 10. Bệnh nhân nữ 66 tuổi có tăng huyết áp khó điều trị. (A) Ảnh siêu âm Doppler màu phát hiện aliasing (mũi tên) ở gốc động mạch thận phải. Aliasing xảy ra khi tốc độ dòng máu vượt quá giới hạn Nyquist và giúp đặt cửa Doppler đúng chỗ để đo PSV tối đa. (B) Doppler xung cho thấy PSV tăng tới 282 cm/s ở vị trí aliasing, khẳng định chẩn đoán hẹp động mạch thận.

Hình 11. Hẹp động mạch thận phải do loạn sản xơ cơ ở bệnh nhân nữ 43 tuổi có tăng huyết áp nặng. (A) Siêu âm màu thấy aliasing ở đoạn giữa động mạch thận phải, vị trí điển hình của loạn sản xơ cơ. (B) động mạch nhu mô có AT = 120 ms. (C) Tăng tốc độ quét ảnh để làm rộng hay phóng đại phổ để đo AT và AI dễ dàng và chính xác. (D) Chụp mạch bằng MRI chứng minh hình tràng hạt (mũi tên) ở đoạn 1/3 giữa của thân chính động mạch phải, chẩn đoán loạn sản xơ cơ.
Ghi chú:
Tỉ số khả dĩ (likelihood ratio) dương và ảnh hưởng đến khả năng hẹp động mạch thận:
LR > 10 thì khả năng hẹp động mạch thận là cao
LR 5 – 10 thì khả năng hẹp động mạch thận là trung bình
LR < 2 thì khả năng hẹp động mạch thận là rất thấp
LR = 1 thì thông số chẩn đoán vô dụng
Tỉ số khả dĩ âm và ảnh hưởng đến khả năng không hẹp động mạch thận:
LR < 0.1 thì khả năng không bị hẹp là cao
LR 0.1 – 0.2 thì khả năng không hẹp động mạch thận là trung bình
LR 0.2 – 0.5 thì khả năng không hẹp động mạch thận là thấp
LR > 0.5 thì khả năng không hẹp động thận là rất thấp
LR = 1 thì thông số chẩn đoán vô dụng
Tham Khảo và Dịch
1. Mann SJ, Pickering TG. Detection of renovascular hypertension: state of the art: 1992. Ann Intern Med 1992; 117: 845–53.
2. Garovic VD, Textor SC. Renovascular hypertension and ischemic nephropathy. Circulation 2005; 112: 1362–74.
3. Scoble JE, Hamilton G. Atherosclerotic renovascular disease: remedial cause of renal failure in the elderly. BMJ 1990; 300: 1670–1.
4. Kaplan NM. Clinical hypertension. Baltimore (MD): Williams & Wilkins; 1990. p. 303–32.
5. Gutzman R, Zierler R, Isaacson J, et al. Renal atrophy and arterial stenosis: a prospective study with duplex ultrasound. Hypertension 1994; 23: 346–50.
6. Textor SC, Wilcox CS. Renal artery stenosis: a common, treatable cause of renal failure? Annu Rev Med 2001; 52: 421–42.
7. Gottlieb RH, Luhmann K, Oates RP. Duplex ultrasound evaluation of normal native kidneys and native kidneys with urinary tract obstruction. J Ultrasound Med 1989; 8:609–611.
8. Berland LL, Koslin DB, Routh WD, Keller FS. Renal artery stenosis: prospective evaluation of diagnosis with color duplex US compared with angiography. Radiology 1990; 174:421-423.
9. Desberg AL, Paushter DM, Lammert GK, et al. Renal artery stenosis: evaluation with color Doppler flow imaging. Radiology 1990; 177:749-753.
10. Miralles M, Cairols M, Cotillas J, Gimenez A, Santiso A. Value of Doppler parameters in the diagnosis of renal artery stenosis. J Vasc Surg 1996; 23:428-435.
11. Handa N, Komada T. Efficacy of echo-Doppler examination for the evaluation of renovascular disease. Ultrasound Med Biol 1988;
12. Williams GJ, Macaskill P, Chan SF, et al. Comparative accuracy of renal duplex sonographic parameters in the diagnosis of renal artery stenosis: paired and unpaired analysis. AJR Am J Roentgenol 2007; 188:798–811.
13. Lee HY, Grant EG. Sonography in renovascular hypertension. J Ultrasound Med 2002;21:431–41.
14. House MK, Dowling RJ, King P, Gibson RN. Using Doppler sonography to reveal renal artery stenosis: An evaluation of optimal imaging parameters. AJR Am J Roentgenol 1999; 173:761–765.
Nguồn https://bsxqtuan.wordpress.com/2012/08/23/sieu-am-doppler-mau-hep-dong-mach-than/

![[Giới thiệu] Chẩn đoán hình ảnh CỘNG HƯỞNG TỪ toàn thân – GS. Phạm Minh Thông](https://virad.org/wp-content/uploads/2024/05/Chan-doan-hinh-anh-CONG-HUONG-TU-toan-than-2.jpg)